临床研究方案是临床研究设计、实行、报告和评价的基础。然而,临床研究方案及现存的临床研究方案指引在内容和质量上差异很大。本文描述了《规范临床研究方案内容》(Standard Protocol Items: Recommendations for Interventional Trials 2013),简称SPIRIT 2013声明,一个临床研究方案必须报告的条目指引的系统建立和范围。包含33个条目的SPIRIT 2013条目清单可应用于所有的临床研究,并且着眼于内容而非形式。清单完整描述了临床方案应该准备什么,而非如何去设计或者实行一个试验。通过提供关键内容的指引,SPIRIT推荐旨在促进高质量临床研究方案的制定。遵循该建议亦将有助于提高方案的透明度和完整性,这将使研究者、受试者、患者、赞助者、资助者、研究伦理委员会或机构评议委员会、同行评议者、杂志、试验注册机构、决策者、协调者及其他相关主体均受益。
1.引言
临床研究方案详细记载了临床研究从申请伦理委员会批准到结果传播的全过程,在临床研究的计划、实行、诠释、监测及外部评审中均起到关键的作用。一个良好的临床研究方案可以在试验开始前允许关于该试验科学性、伦理要求及安全性方面等的合理评价;在试验进行中提高关于其与原方案一致性及其严谨性的评价;在试验结束后提供对于试验实施和结果的全面评价。杂志编辑、同行评议者、研究者和公众利益维护者等亦非常强调试验方案的重要性。
除了试验研究方案的核心角色,系统评价也表明,现有的关于方案内容的指引在范围和推荐项目上差异很大,极少描述临床试验方案指引是如何构建的,也很少参考广泛利益各方的参与或经验证据以支持其推荐内容。这些不足可以部分解释改进临床研究设计方案的必要性。许多随机对照试验的研究方案未提供足够的资料来描述主要的结局指标(25%报告不足)、治疗分配方法(54%~79%报告不足)、盲法(9%~34%报告不足)、不良反应的方法(41%报告不足)、样本量的计算(4%~40%报告不足)、资料分析方案(20%~77%报告不足)、发表政策(7%报告不足),以及赞助者和研究者在试验设计或获取资料方面的角色(89%~100%不足)。这些研究方案的不足可以导致完全可以避免的研究方案修改、试验实行的缺陷,及试验发表报告的不足等。
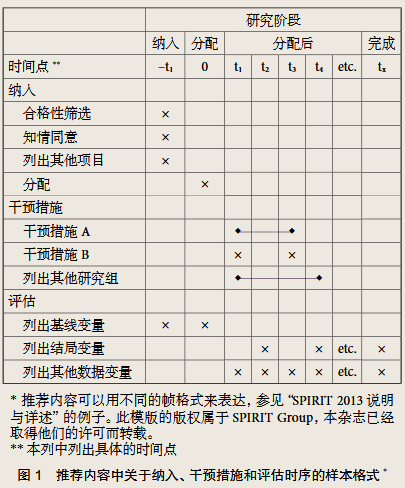
鉴于在方案内容和指引方面的缺陷,我们在2007年启动了规范临床研究方案内容即SPIRIT(Standard Protocol Items: Recommendations for Interventional Trials)。这个国际合作项目通过循证医学为基础的推荐方法,提供在临床研究方案中包括的必要条目,从而提高临床研究方案的完整性。SPIRIT 2013声明包括33项条目清单(表1)和一张图表(图1)。相关的SPIRIT 2013说明与详述则具体叙述了每一条目的合理性及支持证据,并附有指引和来自真实研究方案的实例。


2.SPIRIT 2013声明的发表过程
SPIRIT 2013声明是在广泛咨询了115位临床研究方案利益相关主体后发展起来的,他们包括试验研究者(30人)、医疗专业人员(31人)、方法学专家(34人)、统计学家(16人);试验协调者(14人)、杂志编辑(15人)、研究伦理委员会代表(17人)、企业和非企业资助者(7人)及监管机构人员(3人)等,其角色不是相互排斥的。像稍后详述的,SPIRIT声明的发展,经过了2个系统评价,1个正式的Delphi程序,2个面对面的共识会议和1个预试验才建立起来。
SPIRIT条目清单经历了几次修改。一开始,我们从研究方案指引的系统评价中提取了59个条目作为原始条目。2007年,来自1个低收入、6个中等收入、10个高收入国家(共17个国家)的96位专家组成员通过3轮电邮及采用反复的Delphi共识调研方法(Delphi consensus survey)重新审议了条目。专家组成员对每个条目进行评分(1分代表不重要,10分代表非常重要),提议新的条目并提供意见,而这些内容均会在下一轮的讨论中传阅。在最后一轮,平均分在8分或以上的条目入选,而那些平均分在5分或以下的条目则会被排除,平均分在5分和8分之间的条目则留待共识会议中讨论。
在Delphi调研后,16个SPIRIT委员会成员(该文的作者们)于2007年12月在加拿大安大略省的渥太华市及2009年9月14个委员在加拿大安大略省的多伦多市分别召开会议,检讨调研的结果,讨论有争议的条目,并加工条目的草稿。会议结束后,修改的条目在SPIRIT委员会中继续传阅以取得更多的回馈。
第二篇系统评价确认了一些经验性证据,着重讨论试验实施或偏倚风险的相关具体条目。这篇评价的结果有助于SPIRIT组S纳入和排除条目的决定,并且为SPIRIT 2013说明与详述提供了证据。有些条目缺乏或没有可确认的经验证据(例如题目),但基于强烈的务实或伦理学原则而被纳入。
最后,我们在2010和2011年预测试了草拟的检查条目,在多伦多大学研究生中应用该条目来设计临床研究方案,作为硕士水平的临床方法学课程的一部分。通过匿名问卷调查他们对于内容、格式和条目用途方面的回馈,补充于最后版本的SPIRIT条目清单中。
3.临床研究方案的定义
虽然每个研究都需要有研究方案,但研究者、赞助者和其他相关者对于确切定义研究方案差异较大。在SPIRIT项目中,研究方案被定义为一份提供足够细节的文件,旨在让人们理解研究项目的研究背景、理念、目的、研究人群、干预措施、方法、统计分析、伦理学考虑、传播计划、研究的行政管理等;同时了解研究方法和实施中关键方面的可重复性;以及为伦理学批准到试验结果传播过程中对试验科学性和伦理学严谨性的评价提供依据。
临床研究方案不仅仅是一些条目的罗列,它应是整合有序的文件,可以提供合适的上下文及叙述以便于全面了解研究的要素。例如,关于一项复杂治疗措施的描述需要包括训练材料和图表以便于相应专业的人员可以重复。
完整的研究方案必须递交给研究伦理委员会或机构评议委员会(institutional review board,IRB)来批准。我们建议试验者或者赞助者在递交研究方案时应包括SPIRIT条目清单。如果其中某些项目的细节还未完成,这些项目应该在方案中标出并在未来更新。
研究方案是一个“动态”文件,经常会在研究过程中修改。透明地监督试验设计的修改及实施是临床研究科学记录的必要部分。试验的研究者和赞助者对于已经批准的方案应该严格遵循,对于最新版本中研究方案的修改也要记录在案。重要的方案修改应该向机构评议委员会(IRB)和试验注册机构汇报,也要在试验的报告中描述。
4.SPIRIT 2013声明的范围
SPIRIT 2013声明包括试验方案的全部内容,也包括其附录。临床试验是指前瞻性的有一个或以上的干预措施应用于参试者来评价与健康相关的结局疗效的研究。SPIRIT 2013声明主要应用于随机研究,但其他类型的临床研究,就其不同的研究设计、干预措施或者选题等均可以考虑应用。
SPIRIT 2013声明为临床研究方案所应包含的最基本内容提供指引。有些特定环境下的试验需要包括其他的条目。例如,析因设计需要特定的理据;交叉试验有独特的统计学考虑,如传递效应(carry-over effects);业界赞助的试验可能需要有额外的监管。
研究方案和附录很多时候都是设定每一个具体检查条目的唯一数据库。利用现有的研究方案,我们能够为每一个条目提供实例,从而形成一个方案文件,体现所有纳入条目于一个研究方案的可行性。对一些试验而言,S相关的细节会体现于相关的文件中,如统计分析的计划,病例纪录表,研究实施手册,或者研究者合约等。在这些情况下,研究方案必须概述关键的原理以及提到相关的文件,使读者知道它们的存在。
SPIRIT 2013声明主要对方案的内容提供指引而并非方案的格式,因为后者往往受到当地的法规、传统和标准化的操作流程影响。但是,遵循一些特定的格式,如图表内容、章节的题目、词汇表、缩略词表、参考文献、程序等的招募患者流程图、干预措施、评估等将会促进研究方案的检讨(图1)。
最后,SPIRIT 2013声明的目标是促进研究的透明度、描述整个研究计划而非指导如何设计一个试验或者实施一个临床试验。条目清单亦不应该用于判断该临床试验的优劣,因为一个设计差的研究亦可能包含所有条目的内容与陈述其设计不足的方面。然而,SPIRIT 2013的使用将会提醒研究者所有在临床试验前应该注意的重要事项,从而提高临床研究的可靠性与成功率。
5.与现存临床研究指引之间的关系
有系统的开发过程、咨询国际利益相关者、以及解释性文件援引相关的实证,SPIRIT 2013都是建立在其他适用于临床试验方案的国际指引之上的。它遵循了2008年《赫尔辛基宣言》规定的伦理原则,尤其是研究方案中需要指出特定的伦理学要求,如竞争利益等。
另外,SPIRIT 2013声明包含1996年协调良好临床实践国际会议(International Conference on Harmonisation Good Clinical Practice,GCP)E6指南的推荐,该指南旨在协调良好临床试验规范,并规范临床试验的法规。SPIRIT 2013声明在此基础上提供研究方案中关键的条目(如分配隐藏、试验注册、知情同意过程等)。与SPIRIT 2013相反,良好临床试验规范指引在达成共识方法,以及各人员之间的贡献等的描述不清晰,也缺乏应用实证来支持。
SPIRIT 2013声明同样支持世界卫生组织(WHO)关于临床试验注册的要求、国际医学杂志编辑委员会(International Committee of Medical Journal Editors)的要求、以及关于临床研究登记网站(Clinical Trials.gov)及欧盟(European Commission)、还包括其他组织的注册要求。例如,条目2b建议列出WHO的注册数据所包括的所有项目(附录,可见于www.annals.org),这也是国际医学期刊杂志编辑委员会的最基本要求。设立这些注册推荐不但是试验概述格式的需要,也有助于提高有临床研究注册制度的国家其注册内容的质量。注册所需要的特定资料可以容易地从试验方案内的章节中确认出来,并复制入相应的项目中。除此以外,注册内容的修改也可以提醒研究者更新他们的注册内容。
SPIRIT 2013声明反映了CONSORT2010(Consolidated Standards of Reporting Trials)声明的相关内容。遣词造句和文章结构上的一致性,方便研究者将SPIRIT 2013声明为基础的研究方案转化为CONSORT的最后报告。SPIRIT团队同样希望其他致力于研究方案标准化的领导者,如临床研究注册机构、临床资料内部共享标准联盟当中的研究方案表述小组,以及健康照顾中的务实性随机临床试验小组等,一起努力来推动研究方案内容的透明化和高质量。
6.潜在的益处
众多临床研究相关主体可从SPIRIT 2013声明及其说明与详述的文件中受益(表2)。预测试和非正式的回馈显示,SPIRIT 2013声明及其说明与详述对于研究者在准备研究方案时更为有利。同样,SPIRIT 2013声明对于临床研究的新手、同行评议者和伦理委员会成员也提供了重要的信息来源。
SPIRIT 2013声明对于临床研究的实施也有很多益处。临床研究中的一个主要问题在于临床研究方案设计迟迟不能落实、方案不能及时得到伦理委员会批准,以及患者招募过程的延迟。完整的临床研究方案可以有助于改善因数据不全或者信息不清晰而导致对于方案审核所造成的拖延。在临床试验开始前,对临床试验方案的关键信息完整描述及其重要内容的充分考虑,有利于减少以后方案修改的次数和负担,实际上很多针对方案的修改是可以在方案的细心草拟和发展过程中避免的。如果伦理委员会、基金提供者以及法规制定者均能广泛接受SPIRIT 2013声明作为一个标准,那么研究者及基金支持者只需要按照标准的SPIRIT来撰写一个研究方案,从而简化他们的工作。良好的研究方案也有助于研究执行者按照研究设计者的初衷来实施。
此外,遵守SPIRIT 2013声明还能保证临床试验方案包括了对临床研究进行批判性评价和研究结果诠释所必要的信息。高质量的研究方案会提供从杂志和试验注册资料中难以获取的研究方法和研究方案实施的重要信息。作为研究者原始的、公开的记录之一,研究方案与最终试验报告的比较,也会有助于辨识结果的选择性报告和未公开的修改,例如对于主要结局指标的修改。但是,一般而言,公众是难以取得研究试验方案的。若研究方案能够公开让公众评价其合法性和普及性,则SPIRIT 2013声明将会更有效。
SPIRIT 2013声明需要临床试验主要相关的主体者的支持以取得更大的效果(表2),就像CONSORT声明被广泛接受一样。我们将支持SPIRIT 2013声明的组织在SPIRIT网页上公布(www.spiritstatement.org),并提供足够的资源来实施。广泛接受SPIRIT可以有助于提高研究方案的草拟,提高内容和实施质量;促进临床研究的注册、提高临床研究的效率和研究方案的评估;最终造福于患者,提高试验透明度。

想了解其他更多信息可参阅https://www.equator-network.org/。
引文:SPIRIT 中文工作組.SPIRIT 2013 声明:定义临床研究方案的标准条目[J].中国中西医结合杂志,2014,34(1):0115-0122
http://www.cjim.cn/zxyjhcn/zxyjhcn/ch/reader/view_abstract.aspx?file_no=2014010115&flag=1
摘编:孟保森;文字编辑:格桑玉珍、张璨;审校:米白冰


 陕公网安备61011302000964号
陕公网安备61011302000964号 扫码关注公众号
扫码关注公众号